国际注册/国内NMPA注册
中国NMPA医疗器械注册/备案
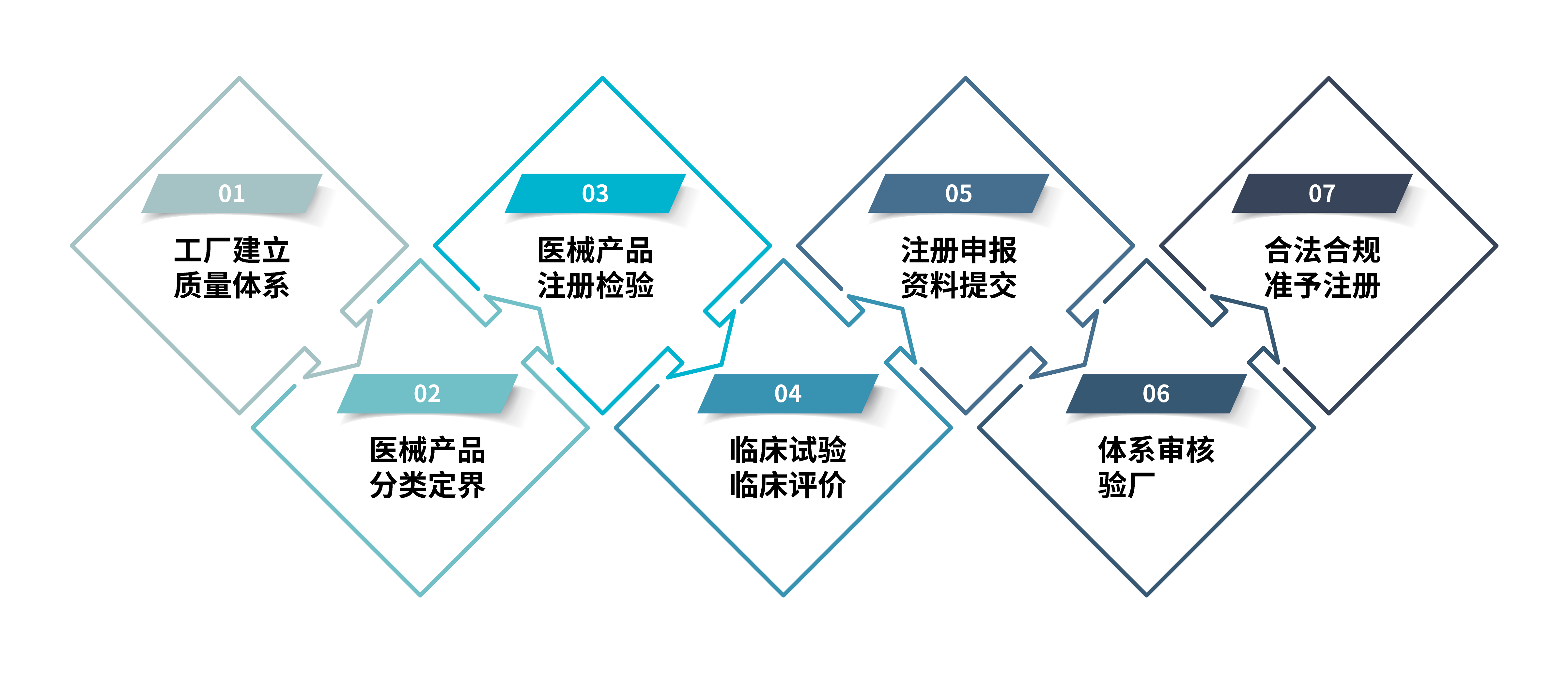
根据中国国务院《医疗器械监督管理条例》规定,任何生产企业希望在中国境内销售、使医疗器械( 包含境内和境外的器械),都应当向相应的食品药品监督管理部门进行注册,按照其风险等级主要分为三类:
1.第一类医疗器械(风险程度低,如纱布、绷带等),实行产品备案管理;
2.第二类医疗器械(中度风险,如输液器、手术手套等),实行产品注册管理;
3.第三类医疗器械(较高风险,如支架、人工关节等),实行产品注册管理。
NMPA注册流程如下:
欧盟CE认证
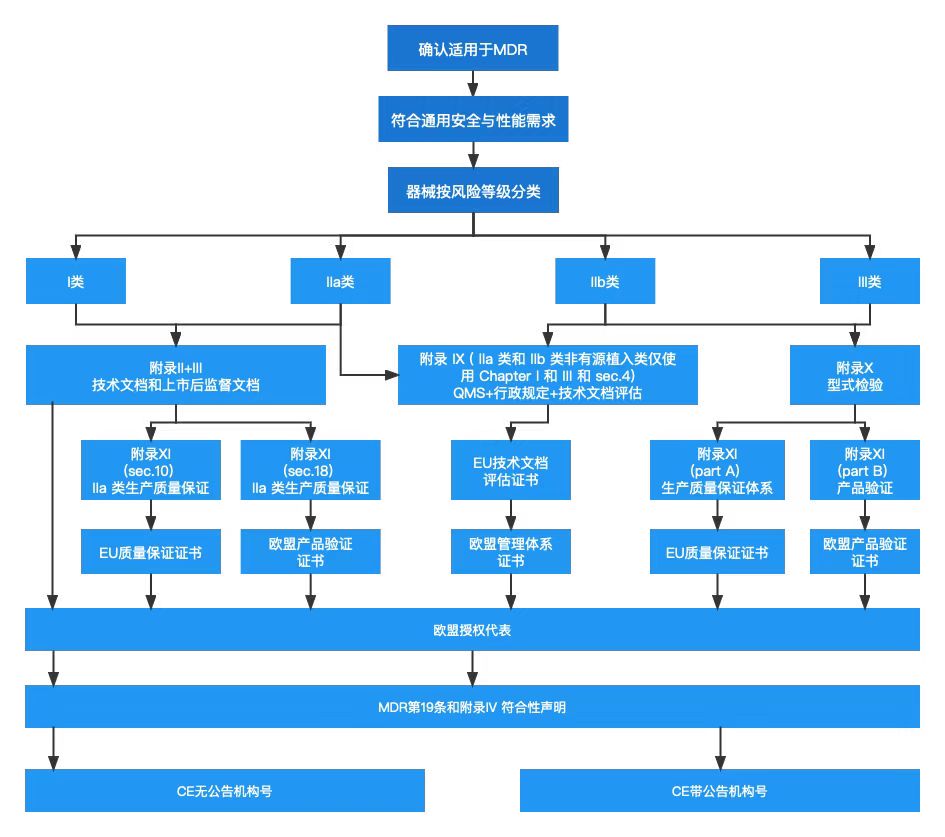
在欧盟市场,“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》法规的基本要求。欧盟CE认证是进入欧盟市场的通行证,出口到欧盟的医疗器械没有CE认证无法清关。医疗器械需要满足的CE指令有《有源植入性医疗器械指令》(AIMDD, 90/385/EEC)、《医疗器械指令》(MDD,93/42/EEC)和《体外诊断器械指令》(IVDD, 98/79/EC),根据医疗器械的风险不同,在欧盟市场医疗器械被划分为Ⅰ、Ⅱa、Ⅱb、Ⅲ四个类别:
1.低风险性医疗器械属于I类,包括:
普通I类医疗器械,需出具CE符合性报告;
具有无菌及测量功能的特殊I类医疗器械,需要CE证书,并在产品包装上打上CE标识。
2.中度风险性医疗器械属于IIa类和IIb类,需要CE证书,并在产品包装上打上CE标识。
3.高度风险性医疗器械属于III类,需要CE证书,并在产品包装上打上CE标识。
CE认证流程如下:
美国FDA认证
FDA认证即美国食品药品监督管理局(Foodand Drug Administration,简称FDA),为确保美国本国生产或进口的食品、化妆品、药物、生物制剂、设备和放射产品的安全而设立的审查机制,在美国等近百个国家,只有通过了FDA认可的材料、器械和技术才能进行商业化临床应用。根据风险等级的不同,FDA将医疗器械分为三类(Ⅰ,Ⅱ,Ⅲ),其中Ⅲ类风险等级最高,风险等级越高则监督越多。FDA明确规定了每一种医疗器械的产品分类和管理要求,FDA医疗器械产品目录已收录超过1700多种产品。医疗器械FDA注册类型包括:
1.厂家在FDA注册;
2.产品的FDA登记;
3.产品上市登记(510表登记);
4.产品上市审核批准(PMA审核);
5.医疗保健器械的标签与技术改造、通关、登记、上市前报告。